TITRASI ASAM KUAT DAN BASA KUAT
Pengertian
Titrasi asam kuat dan basa kuat merupakan suatu metode untuk menentukan kadar dari suatu asam kuat yang direaksikan dengan basa kuat yang telah diketahui konsentrasinya atau menentukan kadar dari suatu basa kuat yang direaksikan dengan asam kuat yang telah diketahui konsentrasinya.
Kurva Titrasi Asam Kuat dan Basa Kuat
Dari video tersebut, kita bisa mengetahui bahwa titik ekivalen dari 25 mL HCl 0,1 M dan NaOH 0,1 M berada pada pH 6,99 dengan volume NaOH yang dibutuhkan sebanyak 25 mL. Jika diperhatikan kembali, terjadi perubahan warna (dari bening ke merah muda) pada larutan setelah diberi penambahan 0,1 mL NaOH yang mengakibatkan pH berubah secara signifikan. Oleh sebab itu sistem akan mengalami titik akhir titrasi.
Berikut untuk kurva titrasi asam kuat dan basa kuat dapat dilihat dari gambar di bawah ini!
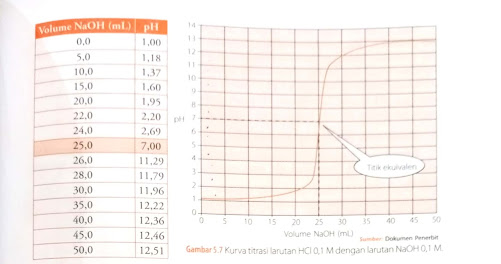 |
| Gambar 1. Kurva titrasi larutan HCl 0,1 M dengan larutan NaOH 0,1 M Sumber: Sudarno dan Mitayani, 2016 |
 |
| Gambar 2. (a) HCl dengan NaOH (b) NaOH dengan HCl Sumber: https://mplk.politanikoe.ac.id/ |
Kurva titrasi merupakan kurva yang menyatakan hubungan antara pH larutan dengan volum titran (Day dan Underwood, 1999). Dari kurva tersebut, dapat diketahui terjadi perubahan pH yang signifikan pada rentang pH 4-10, artinya pada rentang tersebut terjadi reaksi netralisasi, yakni adanya kesetimbangan pada jumlah mol H+ dari asam dan jumlah mol OH- dari basa.
Ingat ini yuk! 😄
- Titik ekivalen titrasi asam kuat dan basa kuat berada pada pH 7.
- Indikator yang tepat untuk digunakan pada titrasi asam kuat dan basa kuat adalah bromtimol biru, metil merah, dan fenolftalein.
- Daerah perubahan pH drastis pada 4-10.
Referensi:
Sudarmo, U dan Mitayani, N. (2016). Kimia untuk SMA/MA Kelas XI. Jakarta: Erlangga.
Day dan Underwood, (1999). Kimia Analisis Kuantitatif. Jakarta: Erlangga.






Komentar
Posting Komentar